Vacíos legales permiten que productos de laboratorios desaprobados por la Digemid sigan en el mercado. La burocracia y la falta de autonomía frenan la fiscalización, mientras se acumulan más de 300 solicitudes pendientes
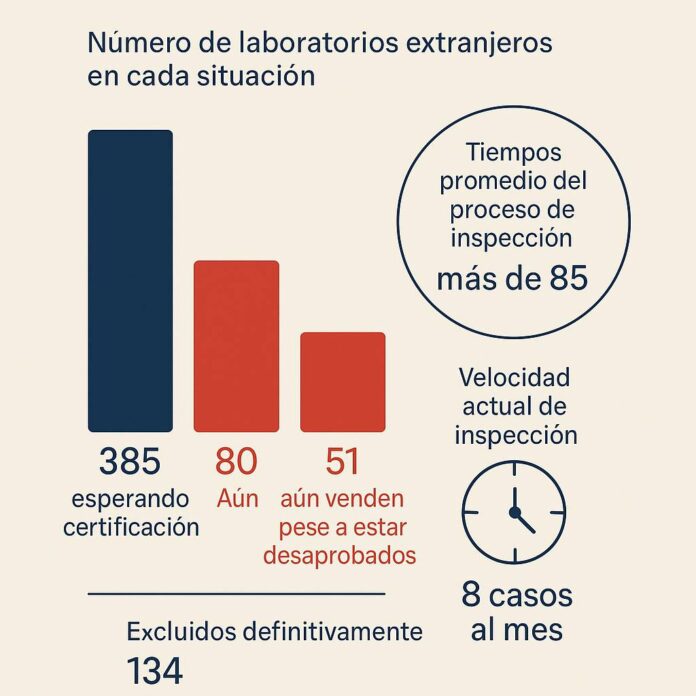
Pese a no cumplir con las Buenas Prácticas de Manufactura (BPM), 51 laboratorios extranjeros continúan vendiendo medicamentos en el Perú. La Dirección General de Medicamentos, Insumos y Drogas (Digemid) ya los desaprobó en inspecciones sanitarias, pero sus productos siguen en farmacias gracias a vacíos legales que impiden su retiro inmediato del mercado.
Hasta el 13 de marzo de 2025, Digemid había rechazado la certificación de 80 laboratorios tras constatar que no cumplían con los estándares internacionales de fabricación segura. No obstante, más de la mitad de ellos aún mantiene vigente el registro sanitario de al menos uno de sus productos, lo que les permite comercializar el stock disponible, aunque ya no puedan importar nuevos lotes.
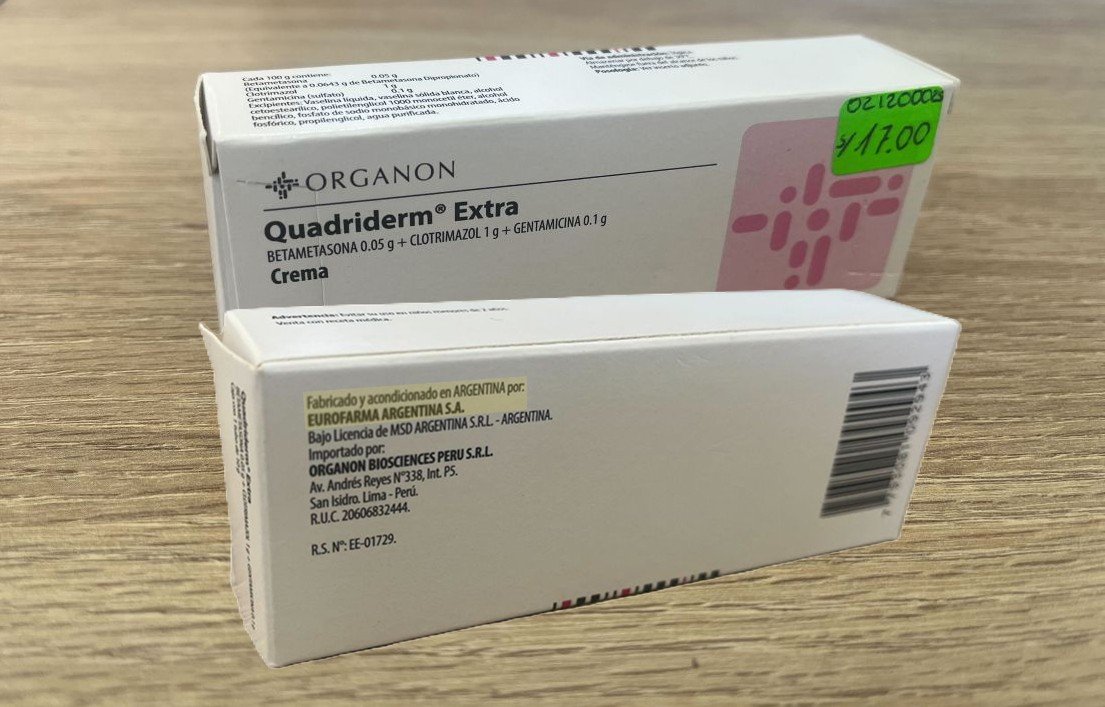
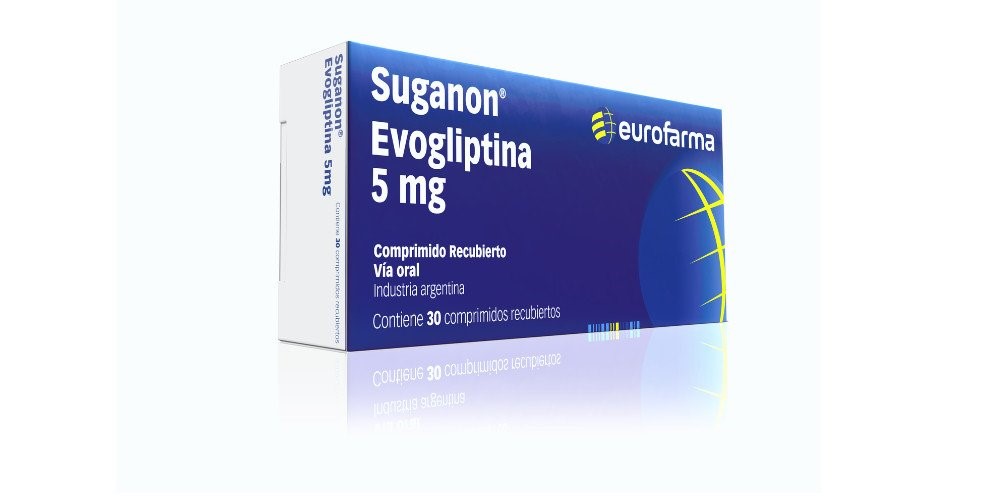
Uno de los casos más emblemáticos es el de Eurofarma Argentina S.A., que no logró la certificación, pero aún vende en el país medicamentos como Suganon para la diabetes tipo 2 y Quadriderm Extra, usado contra infecciones cutáneas. Su casa matriz, en Brasil, también fue desaprobada, aunque conserva registros de hasta 126 productos y 20 solicitudes de reinscripción en trámite.
Barrera legal, ventana comercial
El vacío legal radica en que la normativa peruana no contempla la cancelación automática de registros sanitarios ante la pérdida de certificación BPM. Según el químico farmacéutico Javier Llamoza, esto representa un riesgo directo para la salud pública. “Si el laboratorio no cumple con las buenas prácticas, sus productos deberían ser inmovilizados de inmediato hasta verificar su calidad”, afirma.
Un cuello de botella sin solución a la vista
Actualmente, 385 laboratorios extranjeros están en proceso de obtener la certificación BPM, requisito para seguir exportando al Perú. Sin embargo, el sistema no da abasto. El trámite puede demorar más de 85 días hábiles y requiere que inspectores de Digemid viajen a las plantas de producción en el extranjero. Esta diligencia depende de autorizaciones del Viceministerio de Salud Pública y de la disponibilidad de fondos que, irónicamente, la propia Digemid no puede gestionar.
En el último año, apenas se avanzó: de 474 laboratorios en espera en 2024, la cifra solo bajó a 385 en 2025. A este ritmo, tomaría más de cuatro años completar las inspecciones pendientes.
Una Digemid debilitada

La raíz del problema es estructural.
Digemid no tiene autonomía administrativa ni financiera. A pesar de generar ingresos por trámites y certificaciones, esos fondos se desvían al Ministerio de Salud, que también controla la autorización de viajes para inspecciones. Con solo 800 trabajadores y limitaciones presupuestales, la entidad enfrenta una industria farmacéutica internacional que no se detiene.
La nueva directora de Digemid, Delia Dávila Vigil, asumió el cargo en medio de la crisis provocada por el suero contaminado de Medifarma, que encendió las alarmas sobre la fragilidad del control estatal. El desafío es mayúsculo: restaurar la confianza en un sistema que hoy muestra fisuras preocupantes.
Reflexión: “Cuando un medicamento entra al país sin garantías de calidad, no solo se pone en riesgo a un paciente, sino a todo el sistema de salud. No es una exageración decir que nuestra regulación está en manos atadas.” Javier Llamoza, químico farmacéutico y especialista en política farmacéutica.
Informe publicado en portal saludconlupa.com